Historia de los Elementos
Los Primeros Científicos y los Elementos: El inglés Robert Boyle se destaca por su definición de elemento. Para Boyle, los elementos debían definirse como las sustancias básicas de las que estaba constituida toda la materia. Esto significaba que un elemento no podía descomponerse en sustancias más simples. Posteriormente, los químicos encontraron semejanzas entre las propiedades físicas y químicas de algunas sustancias simples. Esto los llevó a plantearse la posibilidad Seguir leyendo “Historia y Propiedades de los Elementos Químicos” »

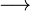 H+ + Cl–
H+ + Cl–