Configuración Electrónica
La manera de mostrar cómo se distribuyen los electrones en un átomo es a través de la **configuración electrónica**. El orden en el que se van llenando los niveles de energía es: **1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p**. El esquema de llenado de los orbitales atómicos se obtiene utilizando la **regla de la diagonal**. Para ello, debes seguir atentamente la flecha del esquema, comenzando en 1s; siguiendo la flecha, podrás ir completando los orbitales con los electrones de forma correcta.
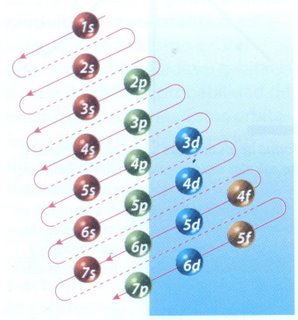
Cómo Escribir Configuraciones Electrónicas
Para escribir la configuración electrónica de un átomo es necesario:
- Saber el **número de electrones** que el átomo tiene; basta con conocer el **número atómico (Z)** del átomo en la tabla periódica. Recuerda que el número de electrones en un átomo neutro es igual al número atómico (Z = p+).
- Ubicar los electrones en cada uno de los **niveles de energía**, comenzando desde el nivel más cercano al núcleo (n = 1).
- Respetar la **capacidad máxima** de cada subnivel (**s = 2e-**, **p = 6e-**, **d = 10e-** y **f = 14e-**).
Electronegatividad
La **electronegatividad** es la tendencia o capacidad de un átomo, en una molécula, para atraer hacia sí los electrones. Ni las definiciones cuantitativas ni las escalas de electronegatividad se basan en la distribución electrónica, sino en propiedades que se supone reflejan la electronegatividad.
La electronegatividad de un elemento depende de su **estado de oxidación** y, por lo tanto, no es una propiedad atómica invariable. Esto significa que un mismo elemento puede presentar distintas electronegatividades dependiendo del tipo de molécula en la que se encuentre, por ejemplo, la capacidad para atraer los electrones de un orbital híbrido spn en un átomo de carbono enlazado con un átomo de hidrógeno, aumenta en consonancia con el porcentaje de carácter s en el orbital, según la serie etano < etileno (eteno) < etino (etino).
Escalas de Electronegatividad
La **escala de Pauling** se basa en la diferencia entre la energía del enlace A-B en el compuesto ABn y la media de las energías de los enlaces homopolares A-A y B-B.
**R. S. Mulliken** propuso que la electronegatividad de un elemento puede determinarse promediando la **energía de ionización** de sus electrones de valencia y la **afinidad electrónica**. Esta aproximación concuerda con la definición original de Pauling y da electronegatividades de orbitales y no electronegatividades atómicas invariables.
**E. G. Rochow** y **A. L. Allred** definieron la electronegatividad como la **fuerza de atracción** entre un núcleo y un electrón de un átomo enlazado.
Estructura de Lewis
La **estructura o diagrama de Lewis** es una representación gráfica que muestra los enlaces entre los átomos de una molécula y los pares de electrones solitarios que puedan existir.

Pasos para Dibujar la Estructura de Lewis
- Determinar el número total de electrones de valencia:
En una molécula neutra, es la suma de los **electrones de valencia** de los átomos que la forman.
En un anión, hay que añadir el número de electrones correspondientes a la **carga del ión**.
En un catión, hay que restar el número de electrones correspondiente a la **carga del ión**.
- Colocar los átomos en sus posiciones relativas:
En algunos casos, solo hay una ordenación posible.
En otros, es necesario recurrir a información experimental para decidir entre dos o más ordenaciones posibles. En este sentido, el **átomo central** suele ser el menos electronegativo.
- Dibujar una línea que representa un enlace sencillo conteniendo dos electrones entre átomos unidos.
- Distribuir los electrones restantes como **pares de electrones de no enlace** en los átomos exteriores, de tal manera que cada átomo tenga ocho electrones (el hidrógeno solo dos), si es posible. Si aún queda algún electrón, este debe ser colocado en el átomo central. Estos electrones se calculan restando al número total de electrones de valencia dos electrones por cada enlace de los dibujados en el paso 3.
- Si el átomo central está rodeado por menos de ocho electrones, hay que desplazar el número suficiente de **pares de electrones de no enlace** de los átomos exteriores (a excepción de los halógenos), colocándolos entre los átomos enlazados y transformándolos en **pares de electrones de enlace** con el objetivo de que el átomo central pase a estar rodeado de ocho electrones.
- Asignación de cargas formales. La **carga formal** de un átomo en una molécula se calcula:
Carga formal = nº electrones de valencia del átomo – [mitad del nº de electrones compartidos + nº de electrones no compartidos]
